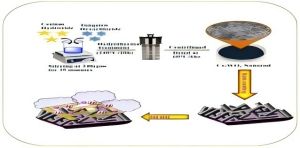
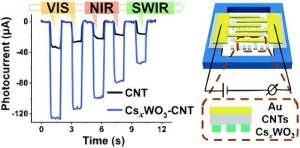
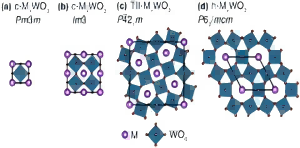
UrbanMines Tech., Ltd. Gespecialiseerd in het onderzoek, de productie en het aanbod van hoge zuiverheidsverbindingen van wolfraam en cesium. Veel binnenlandse en buitenlandse klanten kunnen niet duidelijk onderscheid maken tussen de drie producten van cesium wolfraambrons, cesium wolfraamoxide en cesium tungstate. Om de vragen van onze klanten te beantwoorden, heeft de afdeling Technical Research and Development van ons bedrijf dit artikel opgesteld en grondig uitgelegd. Cesium wolfraambrons, cesium wolfraamoxide en cesium tungstate zijn drie verschillende verbindingen van wolfraam en cesium, en ze hebben hun eigen kenmerken in chemische eigenschappen, structuur en applicatievelden. De volgende zijn hun gedetailleerde verschillen:
1. Cesium wolfraam Bronze CAS No.189619-69-0
Chemische formule: meestal CSₓWO₃, waarbij x de stoichiometrische hoeveelheid cesium vertegenwoordigt (meestal minder dan 1).
Chemische eigenschappen:
Cesium wolfraambrons is een type verbinding met chemische eigenschappen vergelijkbaar met die van metallisch brons, voornamelijk een metaaloxidecomplex gevormd door wolfraamoxide en cesium.
Cesium wolfraambrons heeft een sterke elektrische geleidbaarheid en elektrochemische eigenschappen van bepaalde metaaloxiden en heeft over het algemeen een goede stabiliteit voor warmte- en chemische reacties.
Het heeft een bepaalde halfgeleider of metaalgeleidbaarheid en kan bepaalde elektromagnetische eigenschappen vertonen.
Toepassingsgebieden:
Katalysator: als functioneel oxide heeft het belangrijke toepassingen in bepaalde katalytische reacties, vooral bij organische synthese en omgevingskatalyse.
Elektrische en elektronische materialen: de geleidbaarheid van cesium wolfraambrons maakt het gebruikt in elektronische componenten en opto -elektronische apparaten, zoals fotovoltaïsche apparaten en batterijen.
Materialenwetenschap: vanwege de speciale structuur kan cesium wolfraambrons worden gebruikt om de elektrische geleidbaarheid en magnetische eigenschappen van materialen te bestuderen.
2. Cesium tungstate oxide CAS -nummer. 52350-17-1
Chemische formule: CS₂WO₆ of andere vergelijkbare vormen afhankelijk van de oxidatietoestand en structuur.
Chemische eigenschappen:
Cesium wolfraamoxide is een verbinding van wolfraamoxide gecombineerd met cesium, meestal in een hoge oxidatietoestand (+6).
Het is een anorganische verbinding, die een goede stabiliteit en weerstand op hoge temperatuur vertoont.
Cesium wolfraamoxide heeft een hoge dichtheid en een sterke stralingsabsorptievermogen, die röntgenfoto's en andere soorten straling effectief kan beschermen.
Toepassingsgebieden:
Bescherming van straling: Cesium wolfraamoxide wordt veel gebruikt in röntgenapparatuur en stralingsbeveiligingsmaterialen vanwege de hoge dichtheid en goede stralingsabsorptie-eigenschappen. Het wordt vaak aangetroffen in medische beeldvorming en industriële stralingsapparatuur.
Elektronica-industrie: Cesium wolfraamoxide kan ook worden gebruikt om specifieke stralingsafschermingsmaterialen te maken in experimenten met een energieke fysica en elektronische apparatuur.
Katalysatoren: het heeft ook mogelijke toepassingen in bepaalde katalytische reacties, vooral onder hoge temperaturen en sterke stralingsomstandigheden.
1.CESIUM Tungstate CAS-nummer 13587-19-4
Chemische formule: CS₂WO₄
Chemische eigenschappen:
· Cesium tungstate is een type wolfraam, met wolfraam in de oxidatietoestand van +6. Het is een zout van cesium en wolfraam (wo₄²⁻), meestal in de vorm van witte kristallen.
· Het heeft een goede oplosbaarheid en lost op in een zure oplossing.
Cesium tungstate is een anorganisch zout dat over het algemeen een goede chemische stabiliteit vertoont, maar kan minder thermisch stabiel zijn dan andere vormen van wolfraamverbindingen.
Toepassingsgebieden:
Optische materialen: Cesium wolfraam wordt vaak gebruikt bij de productie van een bepaalde speciale optische glazen vanwege de goede optische eigenschappen.
· Katalysator: als katalysator kan het toepassingen hebben in bepaalde chemische reacties (vooral bij hoge temperaturen en zure omstandigheden).
- Tech Field: Cesium Tungstate wordt ook gebruikt bij de productie van enkele high-end elektronische materialen, sensoren en andere fijne chemische producten.
Samenvatting en vergelijking:
| Verbinding | Chemische formule | Chemische eigenschappen en structuur | Hoofdtoepassingsgebieden |
| Cesium wolfraambrons | CSₓWO₃ | Metaaloxide-achtige, goede geleidbaarheid, elektrochemische eigenschappen | Katalysatoren, elektronische materialen, opto-elektronische apparaten, hightech materialen |
| Cesium wolfraamoxide | CS₂WO₆ | Hoge dichtheid, uitstekende stralingsabsorptieprestaties | Stralingsbeveiliging (X-ray afscherming), elektronische apparatuur, katalysatoren |
| Cesium tungstate | CS₂WO₄ | Goede chemische stabiliteit en goede oplosbaarheid | Optische materialen, katalysatoren, hightech-toepassingen |
Belangrijkste verschillen:
1.
Chemische eigenschappen en structuur:
2.
· Cesium wolfraambrons is een metaaloxide gevormd door wolfraamoxide en cesium, die de elektrochemische eigenschappen van metaal of halfgeleiders vertonen.
· Cesium wolfraamoxide is een combinatie van wolfraamoxide en cesium, voornamelijk gebruikt in hoge dichtheids- en stralingsabsorptievelden.
· Cesium tungstate is een combinatie van wolfraam- en cesiumionen. Het wordt meestal gebruikt als anorganisch zout en heeft toepassingen in katalyse en optica.
3.
Toepassingsgebieden:
4.
· Cesium wolfraambrons richt zich op elektronica, katalyse en materiaalwetenschap.
· Cesium wolfraamoxide wordt voornamelijk gebruikt bij stralingsbeveiliging en bepaalde hightech-apparatuur.
· Cesium tungstate wordt veel gebruikt in de velden van optische materialen en katalysatoren.
Daarom, hoewel deze drie verbindingen allemaal de elementen cesium en wolfraam bevatten, hebben ze significante verschillen in chemische structuur, eigenschappen en applicatiegebieden.