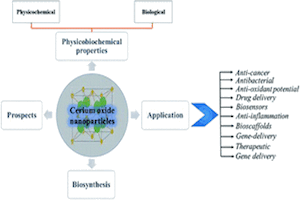
Передумови та загальна ситуація
Рідкісні елементи Земліє дошкою підлоги IIIB скандію, ітрію та лантану в періодичній таблиці. Є елементи L7. Рідкісна Земля має унікальні фізичні та хімічні властивості та широко використовується в промисловості, сільському господарстві та інших галузях. Чистота рідкісних земельних сполук безпосередньо визначає спеціальні властивості матеріалів. Різна чистота рідкісних матеріалів може виробляти керамічні матеріали, люмінесцентні матеріали та електронні матеріали з різними вимогами до продуктивності. В даний час, при розробці технології видобутку рідкісних земель, чисті рідкісні сполуки Землі представляють хорошу перспективу на ринку, а підготовка високоефективних рідкісних матеріалів Землі висуває більш високі вимоги до чистих рідкісних сполук Землі. З'єднання церію має широкий спектр використання, і його ефект у більшості застосувань пов'язаний з чистотою, фізичними властивостями та вмістом домішок. У розподілі рідкісних земельних елементів церій становить близько 50% легких рідкісних земельних ресурсів. Зі збільшенням застосування церій високої чистоти, вимога індексу не рідкісного вмісту землі для церійних сполук вище і вище.Оксид церіює оксидом Сері, число CAS-1306-38-3, молекулярна формула-CEO2, молекулярна маса: 172.11; Оксид церію є найбільш стійким оксидом церій рідкісного землі. Це блідо -жовта тверда речовина при кімнатній температурі і стає темнішим при нагріванні. Оксид церію широко використовується в люмінесцентних матеріалах, каталізаторах, полірувальному порошку, ультрафіолетовому екранізації та інших аспектах завдяки його відмінній продуктивності. В останні роки це викликало інтерес багатьох дослідників. Підготовка та виконання оксиду церію стали дослідницькою точкою в останні роки.
Виробничий процес
Метод 1: Перемішайте при кімнатній температурі, додайте розчин гідроксиду натрію 5,0MOL/L до розчину сульфату церію 0,1MOL/L, відрегулюйте значення рН, щоб бути перевищенням 10, і реакція осадження відбувається. Осадка накачували, кілька разів промивали деіонізованою водою, а потім сушили в духовці 90 ℃ протягом 24 годин. Після подрібнення та фільтрації (розмір частинок менше 0,1 мм) оксид церію отримують і поміщають у сухе місце для герметичного зберігання. Метод 2: прийом церійного хлориду або церійної селітри в якості сировини, регулюючи значення рН на 2 з аміачною водою, додавання оксалату для осадження оксалату церію, після нагрівання, затвердіння, поділу та промивання, сушіння при 110 ℃, потім спалюванням до оксиду церію при 900 ~ 1000 ℃. Оксид церію можна отримати шляхом нагрівання суміші оксиду церію та вуглецевого порошку при 1250 ℃ в атмосфері оксиду вуглецю.
Застосування
Оксид церію використовується для добавок скляної промисловості, шліфувальних матеріалів для пластини, і він розширюється до склянки склянки, оптичні лінзи, кінескоп, відбілювання, уточнення, скло ультрафіолетового випромінювання та поглинання електронного проводу тощо. Він також використовується як антирефлектор для об'єктива окулярів, а церій використовується для виготовлення церійного титану жовтим, щоб зробити скляний світло-жовтий. Рідкісний фронт окислення Землі має певний вплив на кристалізацію та властивості скляної кераміки в системі Cao-Mgo-AI2O3-SIO2. Результати досліджень показують, що додавання відповідного фронту окислення є корисним для поліпшення ефекту роз'яснення скляної рідини, усунення бульбашок, складання скляної структури компактною та покращення механічних властивостей та стійкості до лугу матеріалів. Оптимальна кількість додавання оксиду церію становить 1,5, коли він використовується в керамічній глазурі та електронній промисловості як п'єзоелектричний керамічний проник. Він також використовується у виготовленні каталізатора високої активності, кришці розжарювання газової лампи, рентгенівського флуоресцентного екрану (в основному використовується в полірувальному агенті). Рідкісний полірування церійного церій широко використовується в камерах, лінзах камер, телевізійній картині, об'єктива тощо. Його також можна використовувати в скляній промисловості. Діоксид оксиду церію та титану можна використовувати разом для того, щоб зробити скло жовтого. Оксид церію для знебарвлення скла має переваги стабільної продуктивності при високій температурі, низькій ціні та без поглинання видимого світла. Крім того, оксид церію додається до скла, що використовується в будівлях та автомобілях для зменшення пропускання ультрафіолетового світла. Для виробництва рідкісних люмінесцентних матеріалів оксид церію додається у вигляді активатора в рідкісних триколірних фосфорах, що використовуються в люмінесцентних матеріалах енергозберігаючих ламп та фосфорів, що використовуються в індикаторах та детекторах випромінювання. Оксид церію також є сировиною для приготування металевого церію. Крім того, у напівпровідникових матеріалах, високогранних пігментах та фоточутливому скляному сенсибілізаторі, автомобільний очищувач вихлопу широко використовується. Каталізатор для очищення автомобільних вихлопів в основному складається з керамічного (або металевого) носія та поверхневого активованого покриття. Активоване покриття складається з великої площі гамма-триоксиду, відповідної кількості оксидів, що стабілізують площу поверхні, та метал з каталітичною активністю, що диспергувався всередині покриття. Для зменшення дорогого ПТ дозування РН збільшити дозування ПД порівняно дешево, зменшуйте вартість каталізатора, не зменшуючи каталізатори очищення автомобільних вихлопних вихлопів під передумовою різних продуктивності, зазвичай використовуються PT. PD. Активація покриття каталізатора RH, як правило, загальний метод занурення, щоб додати певну кількість оксиду церію та оксиду лантана, є рідкісним земним каталітичним ефектом. Дорогий металевий потрійний каталізатор. Оксид лантануму та оксид церію використовувались як допоміжні засоби для поліпшення продуктивності ¦ a-alumina, підтримуваних шляхетними металевими каталізаторами. Згідно з дослідженням, каталітичний механізм оксиду церію та оксиду лантану в основному полягає в поліпшенні каталітичної активності активного покриття, автоматично регулювати співвідношення та каталіз повітря та покращити теплову стійкість та механічну міцність носія.